 Die Goethe-Universität Frankfurt am Main bietet Schülerinnen und Schülern der Oberstufe jedes Jahr die Möglichkeit, an einem hochaktuellen biologischen, chemischen oder physikalischen Forschungsprojekt mitzuarbeiten. Dafür werden die Schülerinnen und Schüler von dem Leiter des Projekts Prof. Dr. Arnim Luehken an die Universität eingeladen, in Zweiergruppen eingeteilt und einem Forscher zugewiesen. Diese sollen den Jugendlichen helfen, sich mit der Forschungsarbeit vertraut zu machen und die komplexen Arbeits- und Forschungsprozesse zu verstehen.
Die Goethe-Universität Frankfurt am Main bietet Schülerinnen und Schülern der Oberstufe jedes Jahr die Möglichkeit, an einem hochaktuellen biologischen, chemischen oder physikalischen Forschungsprojekt mitzuarbeiten. Dafür werden die Schülerinnen und Schüler von dem Leiter des Projekts Prof. Dr. Arnim Luehken an die Universität eingeladen, in Zweiergruppen eingeteilt und einem Forscher zugewiesen. Diese sollen den Jugendlichen helfen, sich mit der Forschungsarbeit vertraut zu machen und die komplexen Arbeits- und Forschungsprozesse zu verstehen.
2016 wurden 20 Schülerinnen und Schüler aus Frankfurt und Umgebung nach einem kurzen Bewerbungsverfahren ausgewählt, Teil dieses Projekts zu sein. In den Gruppen erarbeiteten sie die verschiedensten Themen und bereiteten nach zwei Labortagen ein wissenschaftliches Poster sowie eine kurze Präsentation zu ihrer Arbeit vor.
Die beiden angehenden Abiturientinnen der Schule am Ried in Bergen-Enkheim, Ellen Doms und Mara Barthelmes, arbeiteten mit der jungen Biologin Katharina Hötte zusammen, die das Thema ihrer Doktorarbeit als CEF-Projekt zur Verfügung stellte. Frau Hötte arbeitet schon seit mehreren Jahren, zusammen mit ihrem Forschungsteam, an der Darstellung von dreidimensionalen Zellkulturen. Von großer Bedeutung ist diese Technologie im Bereich der Tumor-Forschung, insbesondere für die Krebsheilung.
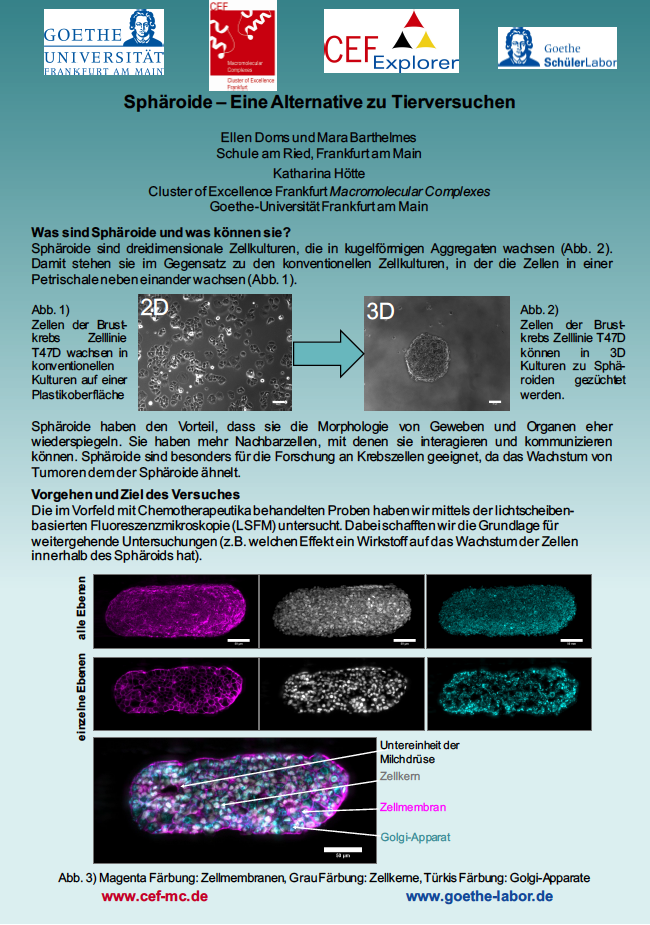
Hierfür verwenden sie sogenannte „Sphäroide“, also dreidimensionale Zellkulturen. Die Forscher sind der Überzeugung, dass man mit funktionierenden Sphäroiden viele Tierversuche ersetzen kann, da die Medikamente erst bei den Sphäroiden zuverlässig anschlagen müssen, bevor sie an Tieren getestet werden. Denn im Gegensatz zu 2D-Zellkulturen, die für gewöhnlich in Petrischalen wachsen, sind die kugelförmigen Zellkulturen wesentlich näher an reellen Zuständen (z.B. im menschlichen Organismus). Des Weiteren bilden sie die Morphologie sowie den Einfluss der Medikamente auf die Zellkultur wesentlich besser ab als das einer zweidimensionalen Zellkultur möglich ist. Jedoch gibt es aufgrund der frühen Entwicklungsstufe bisher wenig Vergleichsergebnisse und außerdem erfordert die Sphäroid-Technologie andere Mikroskopie-Techniken, die den herkömmlichen in der Darstellung zwar deutlich überlegen, aber auch teurer in der Anschaffung sind.
Um Sphäroide herzustellen, müssen die eukaryotischen Zellen in einem konkaven Nährmedium, das nicht in Kontakt mit den Zellen tritt, wachsen, damit mehr Zell-Zell-Kontakte zu Stande kommen und ein kugelförmiges Netz entsteht, das Kommunikation und Wachstum der Kultur erleichtert. Zum Zeitpunkt der Entnahme aus dem Nährmedium werden alle zellulären Prozesse durch Paraformaldehyd eingefroren. Anschließend werden Zellmembranen, Zellkerne und Golgi-Apparate innerhalb der Zellkultur eingefärbt, um die spätere Untersuchung zu erleichtern. Zellmembranen und Golgi-Apparate werden mittels indirekter Antikörperfärbung sichtbar gemacht. Dazu werden die Zellwände zuerst mit einem Detergenz permeabilisiert, damit die Antikörper in das Innere der Zelle diffundieren können. Der primäre Antikörper hat die Aufgabe, eine bestimmte Proteinsequenz, beispielsweise die des GM130-Proteins, das die Golgi-Apparate kennzeichnet, zu erkennen und zu markieren.
Der sekundäre Antikörper erkennt die Markierung des primären Antikörpers und bindet an die verschiedenen Markierungen verschiedene fluoreszierende Farbstoffe. Diese unterscheiden sich in ihrer Anregungs- und Emissionswellenlänge, damit sie nur bei einer bestimmten Lichtsequenz angeregt werden und das Licht emittieren. Die Zellkerne hingegen werden nicht mittels Antikörperfärbung, sondern mit dem bekannten Fluoreszenzfarbstoff 4‘,6-diamidino-2-phenylindole (oder kurz DAPI) versetzt, der sich an die DNA anlagert und auch hier bei einer bestimmten Anregungs- und Emissionswellenlänge des Lichts, die Zellkerne zum „Leuchten“ bringt. Im letzten Schritt wird der Brechungsindex des Sphäroids dem der Lösung angeglichen, um die Lichtstreuung während der Untersuchung unter dem Mikroskop zu minimieren. Dabei wird das Wasser innerhalb der Zellen durch eine aufsteigende Alkoholreihe ersetzt.
Während der Labortage haben wir an fast fertigen Sphäroiden einer Brustkrebszelllinie gearbeitet, die schon mit Chemotherapeutika behandelt waren. Wir haben den letzten Schritt der Herstellung, den Austausch des Wassers innerhalb der Zellen durch eine aufsteigenden Alkoholreihe vorgenommen und danach die Sphäroide unter dem lichtscheibenbasierten Fluoreszenzmikroskop betrachtet, um Besonderheiten der Form und der Eigenschaften der Zellkultur herauszuarbeiten. Dazu wurde der betrachtete Sphäroid mit Hilfe der lichtscheibenbasierten Fluoreszenzmikroskopie in einzelne Ebenen und Zellorganelle zerlegt.
Alle Teilnehmerinnen und Teilnehmer waren sich einig, dass das CEF-Projekt eine tolle Möglichkeit ist, moderne Forschung aus der Nähe zu betrachten und einen Einblick in die Methoden und grundlegenden Prinzipien der Forschungsarbeit zu erhalten. Viele Schülerinnen und Schüler, die ein naturwissenschaftliches Studium anstreben, wurden in ihrem Vorhaben bestätigt und durch das Projekt nochmals motiviert.
